Помогите химия 8 класс
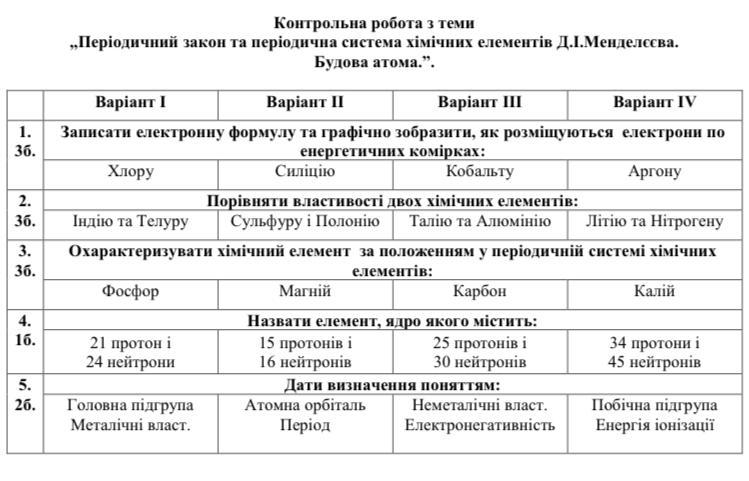
Ответы на вопрос
Відповідь:
2.36)Порівнення Телуру та Індію
Телур- Te, хімічний елемент№52,
6 групи,головній підгрупи, 5-го періоду в періодичній системі, має атомний номер 52; неметал,відноситься до сімейства металоїдів,має металевий блиск.
Фізичний стан: телур є твердим, кристалічним матеріалом за кімнатної температури.,має має блідо-сірий або сірий колір.
Температура плавлення 449,5 °C, кипіння- 988 °C,густина- 6,24 г/см³.
Телур є слабким провідником електричного струму при нормальних умовах, не має магнітних властивостей при нормальних умовах.
Хімічні властивості телура:
досить стійкий до корозії при звичайних умовах температури та тиску. Вищий оксидTeO3,реагує з кислотами, утворюючи гідротелурогалогениди , реагує з багатьма металами, утворюючи сплави.,з основами, утворює телуриди, з галогенами утворює галогеніди телуру.Має38ізотопів,8стабільні
Індій In- це хімічний елемент з порядковим номером 49,. Атомна маса: 114,82 г/моль
Основні фізичні властивості індію:
рідкісний м’який сріблястий метал, що належить до групи металів перехідних елементів
Температура плавлення: 156,6 °C,Температура кипіння: 2 072 °C
Густина: 7,31 г/см,висока електрична і теплопровідність
Хімічні властивості:
оксид-In2O3, реагує з кислотами, утворюючи солі і гідроген. ,
з лугами утворює індієві гідроксиди (In(OH)3).,з галогенами: утворюює галогениди.Має2 ізотопу.
1.36.Характеристика Фосфору.
I. Хімічний елемент номер 15 – Фосфор. Його символ Р.
II. Фосфор знаходиться в головній підгрупі V групи, в 3-му періоді.
III. Заряд ядра атома Фосфору дорівнює +15. Відносна атомна маса Фосфору дорівнює 31. Ядро атома містить 15 протонів і 16 нейтронів (31 – 15 = 16. Атом Фосфору має три енергетичних рівні, на яких знаходяться 15 електронів.
IV. Електронна формула атома Фосфору: 1s2 2s2 2p6 3s2 3p3
валентними електронами є електрони зовнішнього рівня, тобто 3s2 3p3 електрони.
V. Фосфор – неметал. Оскільки останнім підрівнем в атомі Фосфору, який заповнюється електронами, є р -підрівень, Фосфор належить до родини р – елементів.
VI. Вищий оксид Фосфору P2O5: виявляє властивості кислотного оксиду.
Гідроксид, який відповідає вищому оксиду, Н3РО4, виявляє властивості кислоти.
VII. Порівняємо неметалічні властивості Фосфору з властивостями елементів-сусідів за періодом та підгрупою.
Сусідом Фосфору за підгрупою є Нітроген. Сусідами Фосфору за періодом є Силіцій та Сульфур. Неметалічні властивості атомів хімічних елементів головних підгруп зі зростанням порядкового номера зростають у періодах і знижуються у групах. Тому неметалічні властивості Фосфору більш виражені, ніж у Силіцію та менш виражені, ніж у Нітрогену та Сульфуру.
5.26.металеві властивості
За рахунок наявності у кристалах електронів, що вільно рухаються, для більшості металів характерні загальні фізичні властивості: особливий металічний блиск, висока електропровідність і теплопровідність, пластичність, ковкість
Пояснення:
