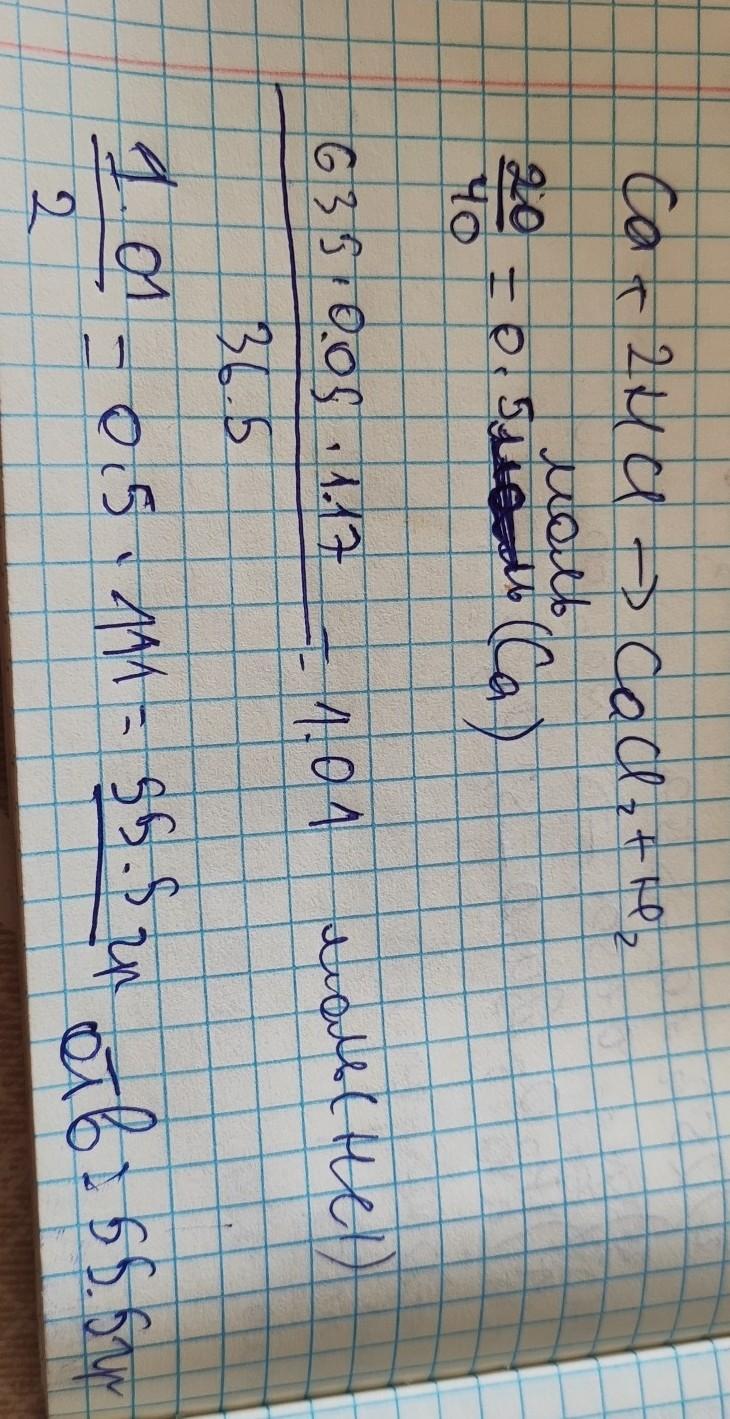Определите массу соли, образовавшейся при реакции 20 г кальция и 635 мл 5%-ного раствора хлороводорода (р = 1,17 г/мл).
Ответы на вопрос
Ответ:
Объяснение:
Чтобы найти массу соли, образовавшейся в результате реакции, нам сначала необходимо определить сбалансированное химическое уравнение реакции между кальцием и хлористым водородом (HCl). В результате этой реакции образуется хлорид кальция (CaCl2) и газообразный водород (H2):
Са + 2HCl → CaCl2 + H2
Далее нам нужно рассчитать количество реагирующих кальция (Ca) и соляной кислоты (HCl):
Моль кальция (Ca):
Данная масса кальция = 20 г.
Молярная масса ofкальций (Ca) = 40,08 g/mol
Моль Ca = масса / молярная масса = 20 г / 40,08 г/моль ≈ 0,499 моль.
Моли хлористого водорода (HCl):
Данный объем раствора HCl = 635 мл.
Плотность раствора HCl = 1,17 г/мл.
Масса HCl в 635 мл = объём × плотность = 635 мл × 1,17 г/мл ≈ 742,95 г
Поскольку раствор представляет собой 5% HCl, то фактическая масса HCl 5% равна 742,95 г = 0,05 × 742,95 г ≈ 37,15 г.
Молярная масса HCl = 1,0079 g/mol (H) + 35,453 g/mol (Cl) ≈ 36,46 g/mol
Моли HCl = масса / молярная масса = 37,15 г / 36,46 г/моль ≈ 1,019 моль.
Поскольку сбалансированное химическое уравнение показывает соотношение кальция и соляной кислоты 1:2, кальций является ограничивающим реагентом. Это означает, что весь кальций вступит в реакцию, и мы получим 1,019 моль CaCl2.
Далее нам необходимо найти молярную массу хлорида кальция (CaCl2):
Молярная масса CaCl2 = 40,08 g/mol (Ca) + 2(35,453 g/mol) (Cl) ≈ 110,986 g/mol
Наконец, мы можем найти массу полученного хлорида кальция:
Масса CaCl2 = моли × молярная масса ≈ 1,019 моль × 110,986 г/моль ≈ 113,33 г
Следовательно, в реакции образуется примерно 113,33 грамма хлорида кальция.
Ответ:
вот здесь я все расписал. А 1.01 моль я поделил на 2, потому что коэффициент HCl 2 и чтобы эту моль я мог использовать на CaCl надо было поделить и получилось 0.5, а 111 это молярная масса CaCl2