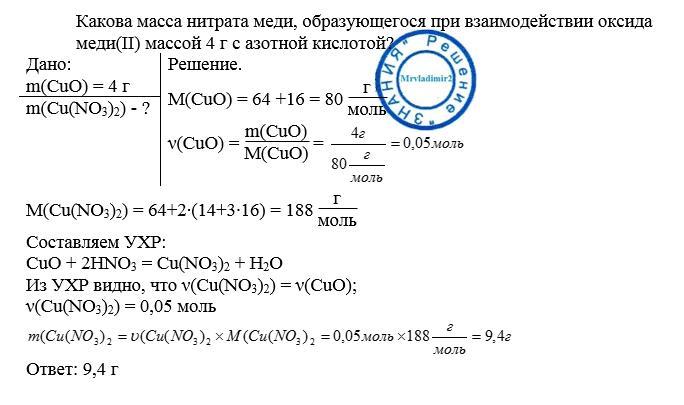
Какова масса нитрата меди, образующегося при
взаимодействии оксида меди(II) массой 4г с азотной кислотой?
Ответы на вопрос
Ответил LVA98
0
Дано:m(CuO) = 4г.Найти: m(Cu(N03)2).
Решение.4 г х гCuO + 2HN03 = Cu(N03)2 + Н201 моль 1 моль80 г 188 гМг(СиО) = 64 4- 16 = 80М(СиО) = 80 г/мольт(СиО) = 80 гMr(Cu(N03)2) = 64 4- 14-2 + 16-6 = 188 М(СиО) = 188 г/моль т(СиО) = 188 г/моль4 г/80 г = х г/188 г; х = 4 г-188 г/80 г = 9,4 г.
Решение.4 г х гCuO + 2HN03 = Cu(N03)2 + Н201 моль 1 моль80 г 188 гМг(СиО) = 64 4- 16 = 80М(СиО) = 80 г/мольт(СиО) = 80 гMr(Cu(N03)2) = 64 4- 14-2 + 16-6 = 188 М(СиО) = 188 г/моль т(СиО) = 188 г/моль4 г/80 г = х г/188 г; х = 4 г-188 г/80 г = 9,4 г.
Ответил mrvladimir2
0
Ответ: 9,4 г
Объяснение:
Приложения:
Новые вопросы
Английский язык,
6 лет назад
Литература,
6 лет назад
Математика,
9 лет назад
Математика,
9 лет назад
Математика,
9 лет назад